La Química desde tus Manos
El presente EduBlog, busca que el educando trabaje con la ciencia Química de la manera más sencilla y divertida posible. También puedes encontrarnos en las redes sociales: Twitter: @quimicajuan23. Facebook: La Química desde tus Manos. Correo Electrónico: laquímicadesdetusmanos@gmail.com.
martes, 2 de julio de 2013
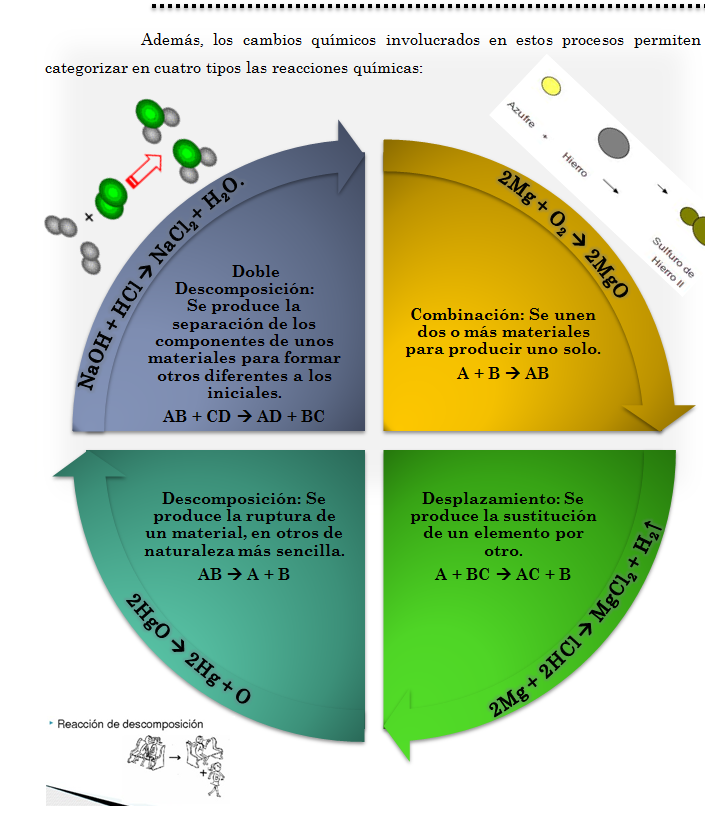
Cambio Químico
Es importante que tengas claro que para
que se represente correctamente un proceso químico, el mismo debe cumplir dos
condiciones:
a.Las
fórmulas químicas escritas en ambos lados de la flecha deben corresponder en su
totalidad al número de materiales químicos que existen en ambos momentos del
proceso.
b. La
Educación debe estar balanceada.
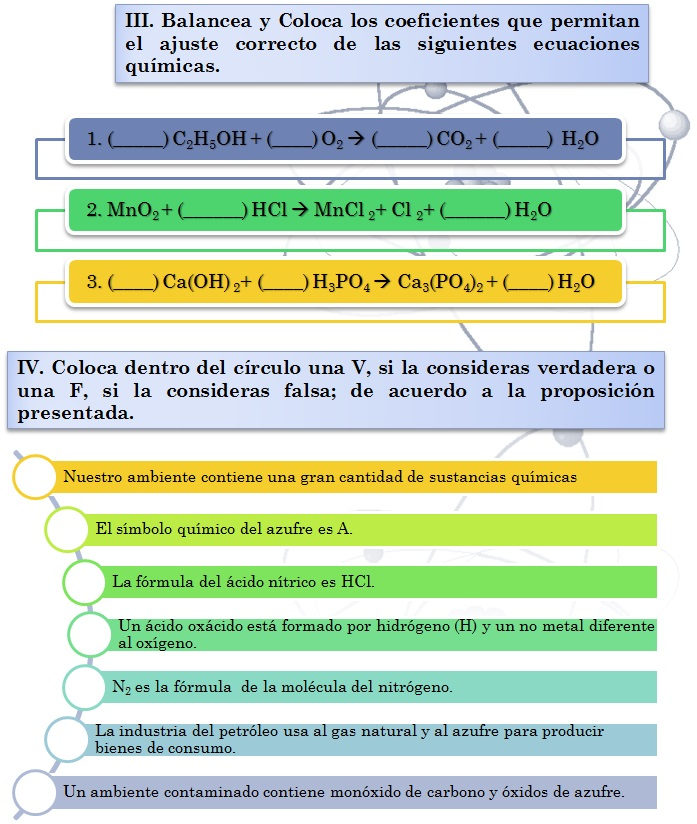
Balanceo
Balanceo,
es sinónimo de equilibrio. En el cual, en una reacción química debe igualarse
el número de átomos de cada uno de los elementos antes y después de la
reacción. A continuación se
te darán algunos ejemplos sencillos para que comprendas claramente dicho
procedimiento que te será útil en el desarrollo de los procedimientos químicos.
 Por Ejemplo para
balancear la siguiente reacción: P + O2
à
P2O5
es necesario que sigas el siguiente
procedimiento:
Por Ejemplo para
balancear la siguiente reacción: P + O2
à
P2O5
es necesario que sigas el siguiente
procedimiento:
1.Vas
a elegir el compuesto que contiene el mayor número de átomos. En este caso
sería el P2O5 .
2.Inicia
el balanceo con el elemento que posee el mayor número de átomos en el compuesto
que seleccionaste, en este caso es el P. Ya que dicho elemento no debe ser
hidrógeno ni oxigeno, ni encontrarse dentro de un ion poliatómico.
3.Como
en los reacciones hay solo un átomo de P y en los productos hay dos, se
colocara un dos delante del P como sustancia pura. Es decir
2P +
O2 à P2O5
4. Como no hay iones poliatómicos se
procederá a balancear el oxigeno. En el caso que
existieran en ambos miembros, se procedería a balancear
cada unidad del compuesto.
5. Como en los reaccionantes hay dos
átomos de oxígeno y en los productos hay cinco, se
procederá a colocar un valor
fraccionario delante del oxígeno
con menor número de átomos, de manera que el mismo tenga
en el numerador la
mayor cantidad de átomos y en el denominador la menor. En este caso sería 5/2. 2P + 5/2 O2
à P2O5
6. Es necesario que verifiques los
coeficientes los cuales deben ser números enteros y en la
proporción más pequeña. Por tanto, para eliminar el 5/2,
debes multiplicar todos los coeficientes por el
mínimo común múltiplo de los números de átomos presentes en cada compuesto. En
este caso sería el número 2. Ejemplo:
2x2P
+ 2x5/2 O2 à 2P2O5
7. Por tanto, constata nuevamente los
coeficientes y cuenta los átomos de cada elemento:
4P
+ 5O2
à 2P2O5
lunes, 1 de julio de 2013
Interactuando con la Química
En este espacio podrás encontrar una página Web, para el estudio teórico y práctico de la Nomenclatura de Química Inorgánica.
Suscribirse a:
Entradas (Atom)